Contoh Studi Kasus Konversi Angka Desimal ke Romawi
Berikut adalah beberapa contoh studi kasus konversi angka desimal ke Romawi:
Contoh 1: Konversi angka desimal 2023 ke Romawi.
Hasil: Angka desimal 2023 dalam angka Romawi adalah MMXXIII.
Contoh 2: Konversi angka desimal 1984 ke Romawi.
Hasil: Angka desimal 1984 dalam angka Romawi adalah MDCDLXXXIV.
Contoh 3: Konversi angka desimal 354 ke Romawi.
Hasil: Angka desimal 354 dalam angka Romawi adalah CCCLIV.
Nah, itu dia informasi lengkap aturan dasar penulisan angka romawi dan penggunaannya dalam sehari-hari. Semoga bermanfaat!
https://p2k.stekom.ac.id/ensiklopedia/Angka_Romawi
https://www.detik.com/edu/detikpedia/d-6673713/begini-cara-menulis-angka-romawi-yang-benar-serta-contohnya
https://byjus.com/maths/roman-numerals/#Definition
https://historylearning.com/a-history-of-ancient-rome/history-of-roman-numerals/
Cek berita, artikel, dan konten yang lain di Google News
Tatkala aku masuk sekolah Mulo, demikian fasih lidahku dalam bahasa Belanda sehingga orang yang hanya mendengarkanku berbicara dan tidak melihat aku, mengira aku anak Belanda. Aku pun bertambah lama bertambah percaya pula bahwa aku anak Belanda, sungguh hari-hari ini makin ditebalkan pula oleh tingkah laku orang tuaku yang berupaya sepenuh daya menyesuaikan diri dengan langgam lenggok orang Belanda.
“Kenang-kenangan” oleh Abdul Gani A.K
Sudut pandang pengarang yang digunakan dalam penggalan tersebut adalah ….
Sobat Zenius, kapan terakhir kali elo dateng ke pesta ulang tahun yang penuh dengan dekorasi balon?
Biasanya, di pesta-pesta yang penuh dekorasi balon, ada balon yang melayang dan ada balon yang diam di lantai. Balon yang melayang biasanya diisi helium dengan alat tertentu, sementara balon lainnya bisa jadi ditiup sendiri menggunakan mulut.
Elo, pernah ngerasa nggak sih, balon yang diisi dengan helium jauh lebih stabil daripada balon yang kita tiup sendiri. Balon dari helium bisa tahan beberapa hari, sedangkan balon yang kita tiup sendiri lebih rawan pecah, apa lagi kalau kita tiup balonnya hingga terlalu besar.
Perbedaan ini terjadi karena kondisi gas di kedua balon ini berbeda. Balon yang diisi dengan helium cenderung menunjukkan gas ideal, sedangkan balon yang kita tiup merupakan gas nyata.
Nah, dalam artikel ini gue akan membahas tentang gas ideal dan gas nyata. Gue akan membahas tentang pengertian gas ideal, perbedaannya dengan gas nyata, serta perhitungan-perhitungannya. Gue juga akan menguji pemahaman elo dengan contoh soal di akhir artikel ini. Simak artikel ini hingga akhir, ya!
Contoh Soal Gas Ideal
Sobat Zenius, setelah memahami penjelasan gue tentang gas ideal dan gas nyata, gue akan kasih elo contoh soal gas ideal supaya elo bisa lebih paham lagi sama materi ini. Coba elo kerjakan ya!
Contoh soal gas ideal 2
Berapa volume gas pada suhu 27 °C, 1 atm (kondisi RTP) jika terdapat 2 mol gas?
Sobat Zenius, di soal ini elo jangan terkecoh sama suhunya ya. Elo perhatikan keterangan dalam soal, yaitu kondisi RTP.
Nah, kita tau nih dalam kondisi RTP, setiap 1 mol gas akan memiliki volume sebesar 24,4 L. Artinya, kalau kita punya 2 mol gas, volume gas yang kita miliki sebesar (A) 48,8 L. Simpel, kan?
Nah, gimana nih? Soal-soal tentang gas ideal masih gampang, kan? Atau elo perlu soal-soal yang lebih menantang lagi? Tenang! Elo bisa buka aplikasi Zenius untuk dapetin contoh soal beserta video pembahasannya.
Elo juga bisa klik banner di bawah ini untuk belajar materi jenis campuran atau materi kimia lainnya. Tinggal klik banner dan ketik materi yang diinginkan di kolom pencarian ya.
Nah, supaya pemahaman elo makin dalam, ikuti terus review materi dan kerjakan berbagai latihan soal di Zenius, yuk. Ada berbagai paket yang bisa elo beli sesuai kebutuhan elo. Klik banner di bawah ini untuk info selengkapnya!
Pembahasan gue tentang materi gas ideal dan gas nyata kelas 11 sampai sini dulu ya! Kalau elo ada pertanyaan, bisa langsung tulis di kolom komentar.
Sampai bertemu di artikel selanjutnya. Semangat terus ya, Sobat Zenius!
Penulis: Trisnajaya Shalsabila
3. Tujuan Kedatangan Portugis dikenal dengan istilah 3G (gold, gospel dan glory). Gospel berarti bahwa Portugis bertujuan ... .A. Memburu kekayaan dan keuntunganB. Mencari dan mengumpulkan emas, perak dan bahan tambangC. Memburu kejayaan, superioritas, dan kekuasaan.D. Mencari rempah-rempah dari TimurE. Menjalankan tugas suci untuk menyebarkan agama
4. Dalam bidang sosial, dampak penjajahan bangsa Eropa adalah ... .
A. Timbul pelapisan sosialB. Timbul hubungan sosialC. Muncul kerjasama sosialD. Lahir badan-badan sosialE. Lahir organisasi sosial
5. Selain dampak buruk, dampak positif yang dirasakan rakyat dalam bidangekonomi akibat penjajahan kolonial adalah ... .
A. Diterapkannya sistem Tanam Paksa bagi IndonesiaB. Belanda mengenalkan sistem ekonomi LiberalC. Adanya pembangunan sarana transportasiD. Adanya penerapan monopoli dagang oleh BelandaE. Penyerahan wajib ada pemungutan pajak hasil bumi
6. Bangsa yang dapat disebut sebagai kolonisator pertama adalah Bangsa.....
A. Eropa dan PortugisB. Portugis dan SpanyolC. Belanda dan InggrisD. Yunani dan PortugisE. Spanyol dan Yunani
7. Latar belakang dan faktor pendorong kedatangan bangsa-bangsa Eropa ke Asia adalah sebagai berikut, kecuali...
A. Keinginan menemukan daerah asal rempah-rempahB. Runtuhnya Konstantinopel ke tangan bangsa Turki Seljuk yang menyebabkan putusnya hubungan dagang Asia-EropaC. Keinginan membuktikan teori Copernicus bahwa bumi bulatD. Penemuan mesin uap oleh James WattE. Rasa tertarik kepada buku karya Marcopolo berjudul Imago Mundi yangmenceritakan kesuburan Asia
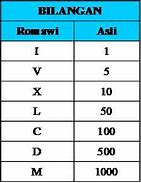
Kelas 4-5 Bilangan Romawi
Konsep Gas Ideal dan Gas Nyata
Nah, gas ideal adalah suatu konsep atau model gas yang dianggap sempurna. Sebagai gas yang sempurna, tentunya ada beberapa kondisi yang harus dipenuhi oleh gas. Syarat-syarat gas ideal di antaranya adalah:
Tapi nyatanya, nggak ada gas yang benar-benar ideal di kehidupan sehari-hari. Mungkin hanya ada beberapa gas yang kondisinya mendekati ideal. Konsep itulah yang disebut sebagai gas nyata.
Lalu, kenapa ada yang namanya gas ideal kalo nyatanya nggak ada yang ideal? Konsep gas ideal ini dirancang dan digunakan untuk mempermudah analisis hubungan antara keadaan makroskopis suatu gas.
Dengan gas ideal, kita bisa menjelaskan kondisi suatu gas melalui tekanan, volume, suhu, hingga jumlah mol-nya.
Contoh soal gas ideal 1
Pernyataan di bawah ini yang tepat terkait dengan hukum yang mendasari persamaan gas ideal adalah ….
A. menurut hukum Boyle, semakin banyak partikel gas, maka semakin kecil volume gas
B. menurut hukum Charles, semakin rendah suhu, maka volume gas akan semakin memuai
C. menurut hukum Avogadro, semakin besar tekanan, maka semakin besar pula volume gas
D. menurut hukum Boyle, semakin besar tekanan, semakin kecil volume gas
E. menurut hukum Avogadro, semakin tinggi suhu, semakin menyusut volume gas
Nah, elo inget kalo ada 4 hukum yang dibahas dalam gas ideal. Hukum Boyle, Hukum Charles, Hukum Gay Lussac, dan Hukum Avogadro. Elo juga perlu inget bunyi-bunyi dari masing-masing hukumnya serta apa kaitan hukum-hukum tersebut dengan gas ideal.
Singkatnya, hukum Boyle bicara tentang tekanan dan volume gas, yaitu tekanan gas berbanding terbalik dengan volume gas. Hukum Charles bicara tentang suhu dan volume gas, yaitu suhu gas berbanding lurus dengan volume gas.
Hukum Avogadro bicara tentang volume dan jumlah mol gas, yaitu volume berbanding lurus dengan jumlah mol gas. Terakhir, hukum Gay Lussac bicara soal tekanan dan suhu gas, yaitu tekanan gas berbanding lurus dengan suhu gas.
Dari ringkasan tersebut, jawaban untuk contoh soal ini adalah (D) menurut hukum Boyle, semakin besar tekanan, semakin kecil volume gas.
Gimana? Gampang, kan? Coba elo kerjain satu soal lagi yang berkaitan dengan perhitungannya ya!
Kondisi Dua Gas dengan Tekanan dan Suhu Sama
Nah, biasanya ada juga kondisi-kondisi yang melibatkan lebih dari satu gas. Gas-gas ini bisa jadi memiliki tekanan dan suhu yang sama. Dalam kondisi ini, kita mendapatkan persamaan gas ideal sebagai berikut:
Artinya, gas-gas ini akan memiliki volume yang sama dan jumlah mol yang sama pula.
Selain kondisi-kondisi di atas, ada juga kondisi gas yang dicampurkan. Dalam beberapa situasi, gas-gas yang berbeda bisa aja dicampurkan dan menghasilkan perhitungan yang berbeda pula. Coba elo cermati ilustrasi berikut ini.
Nah, ketika dua gas tergabung dalam satu wadah, tekanannya juga ikut berubah. Tekanan pada campuran kedua gas ini disebut sebagai tekanan parsial (P’) karena merupakan gabungan dari gas 1 dan gas 2.
Sobat Zenius, dari tadi kita udah bicara soal gas ideal beserta segala macam kondisi dan perhitungannya. Tapi, gas ideal itu sebuah konsep atau model yang sebenarnya nggak nyata di alam. Lalu, kondisi dan perhitungan gas nyata di alam seperti apa?
Pada gas nyata, partikel-partikel gas mengalami interaksi satu sama lain sehingga kecepatan partikel pada gas nyata lebih kecil daripada kecepatan partikel pada gas ideal. Hal ini juga menyebabkan momentum pada gas nyata lebih kecil daripada gas ideal.
Oleh karena itu, volume gas nyata akan lebih besar daripada volume gas idealnya. Selain itu, tekanan gas nyata juga akan lebih kecil daripada tekanan gas idealnya.
Persamaan gas nyata juga akan berbeda-beda tergantung jenis gasnya. Coba elo cermati ilustrasi berikut ini.
Hukum-Hukum Gas Ideal
Sebagai model untuk mempermudah analisis keadaan gas, gas ideal juga punya persamaan perhitungan. Persamaan perhitungan ini berasal dari beberapa hukum, yaitu:
Hukum Boyle memiliki bunyi, “apabila suhu dari suatu gas yang ada di sebuah ruangan tertutup dijaga konstan, maka tekanan gas tersebut akan berbanding terbalik dengan volumenya”.
Dari sini, kita tau kalau hukum Boyle berbicara tentang tekanan dan volume gas. Hukum Boyle juga menyatakan bahwa tekanan dan volume gas berbanding terbalik.
Hukum Boyle : Bunyi dan Rumus
Hukum Charles memiliki bunyi, “apabila tekanan gas yang berada di dalam suatu ruangan tertutup bersifat konstan, maka suhu mutlaknya akan berbanding lurus dengan volume gas”.
Dari sini, kita tau kalo hukum Charles berbicara tentang suhu dan volume gas. Pada tekanan yang tetap, suhu dan volume gas berbanding lurus.
Hukum Charles : Bunyi dan Rumus
Hukum Avogadro memiliki bunyi, “gas-gas dengan volume yang sama, serta pada suhu dan tekanan yang sama akan memiliki jumlah molekul yang sama.”
Dari sini, kita tau kalo hukum Avogadro berbicara tentang volume dan jumlah mol gas. Hukum Avogadro juga menyatakan bahwa volume dan jumlah mol gas berbanding lurus.
Hukum Avogadro : Bunyi dan Rumus
Hukum Gay Lussac memiliki bunyi, “tekanan suatu gas akan berbanding lurus dengan suhu absolutnya pada keadaan volume yang konstan.”
Dari sini, kita tau kalo hukum Gay Lussac berbicara tentang tekanan dan suhu gas. Tekanan dan suhu gas ini berbanding lurus.
Hukum Gay Lussac : Bunyi dan Rumus
RTP (Room Temperature and Pressure)
Kondisi RTP adalah kondisi suatu gas dalam suhu ruangan ketika suhunya sebesar 25°C atau 298 K dan tekanannya sebesar 1 atm. Dari sini, kita bisa mendapatkan persamaan gas ideal sebagai berikut:
Artinya, setiap satu mol gas ideal akan memiliki volume sebesar 24,4 liter. Sama seperti kondisi STP, kondisi RTP ini hanya berlaku untuk gas ideal.
Rumus Gas Ideal dan Gas Nyata
Dari keempat hukum di atas, kita bisa mendapatkan persamaan perhitungan gas ideal. Coba elo simak ilustrasi berikut ini:
Nah, dalam konsep gas ideal juga ada beberapa kondisi khusus yang perlu kita ketahui.
STP (Standard Temperature and Pressure)
Kondisi STP adalah kondisi standar suatu gas, yaitu ketika suhunya sebesar 0°C atau 273 K dan tekanannya sebesar 1 atm. Dari sini, kita bisa mendapatkan persamaan gas ideal sebagai berikut:
Artinya, setiap satu mol gas ideal akan memiliki volume sebesar 22,4 liter. Perlu elo inget, kondisi STP ini hanya berlaku untuk gas ideal.